
“新冠”病毒太狡猾,查漏有办法!

举例
较多的案例也充分证实了这一观点:
杭州某医院的一位患者CT结果高度疑似新冠病毒感染,但连续6次核酸检测结果都为阴性,直到第7次才测出阳性得以确诊。
天津一女性感染病例,1月21日出现发热后,前后共做了三次核酸检测均呈阴性,2月1日第四次检测后才呈阳性。
武汉协和医院发现一例特殊病例,该患者治疗后2次核酸检测均为阴性,符合出院标准,但肺部影像显示仍有病毒感染迹象,需要继续治疗。
此外,近日出现的“三阴”患者,在入院前3次咽拭子核酸检测均为阴性,直到入院后插管上呼吸机,通过肺泡灌洗检测才发现新冠病毒核酸阳性。

“假阴性”病例不会被隔离收治,存在着在人群中继续传播病毒的风险,这也是抗疫环节中的一大阻碍。最近关于假阴性的问题讨论非常热烈,作为一位专门从事RNA分子诊断的小编,也来谈谈我的看法。
新型冠状病毒的检测主要过程涉及到:病毒样本采集、样本保存运输、样本预处理、核酸提取、扩增检测。任何一个环节出现问题都可能导致新型冠状病毒“假阴性”结果的产生。

样本采集
新型冠状病毒与SARS病毒同源性高,且主要感染部位为肺部。从理论上来说,新型冠状病毒的标本采集可首选肺泡灌洗液或深部咳痰,次选鼻拭子/咽拭子。这种病毒分布在肺部的浓度最大,越靠近肺部的样本病毒量越高。要想采肺泡灌洗液,操作复杂,需要仪器和各种引管,且对人的损伤很大,因此只针对上了呼吸机的重症病人;其次是痰,但这次肺炎不像以往的甲流,很多病患干咳,无痰。
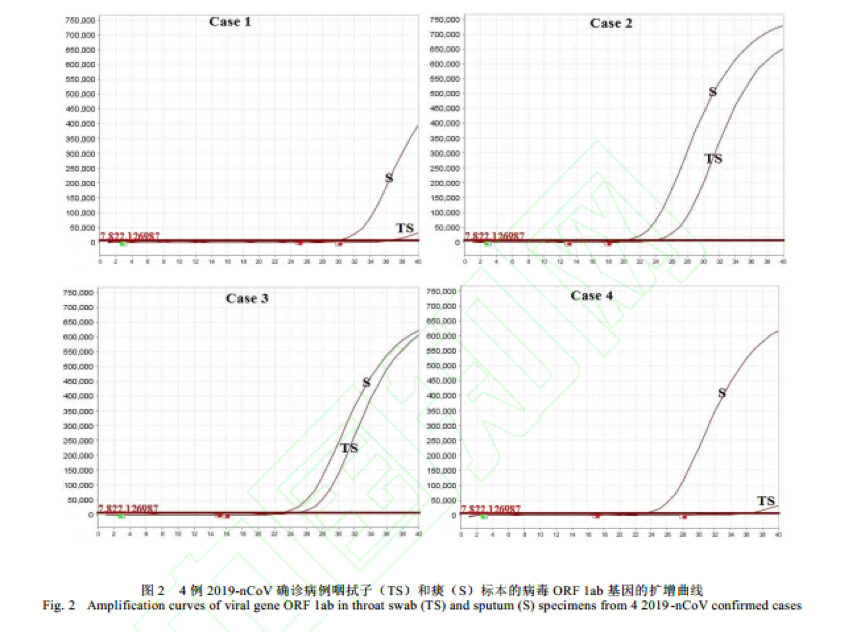
根据最新报道的《4例新型冠状病毒感染病例咽拭子与痰标本病毒核酸检测的比较》,痰标本的扩增曲线信号均比咽拭子强,扩增曲线的 CT 值均低于咽拭子。

然而由于可操作性的限制,最常用的方法为采集鼻咽拭子。鼻咽拭子采集这种方法有先天的局限性,其随机性较高。此外,取样的技术也会影响检测准确性。新型冠状病毒主要感染部位其实是在下呼吸道及肺部,进行咽拭子采上呼吸道样本时,取样的部位不够深就可能到不了咽喉,从而导致假阴性。
样本中病毒含量低,就需要后面的检测性能来弥补,因此在实际检测过程中对新型冠状病毒检测试剂灵敏度及特异性的要求就更高了。灵敏度高,特异性好的试剂能提高对病毒含量低的样本的检出率,同时确保阳性结果的准确性。

保存运输
样本采集后,需要放入容器中进行保存和运输。根据新冠核酸检测试剂的使用说明书来看,目前保存样本的方式一般为:鼻咽拭子样本放入含有1ml无菌生理盐水的试管中密封送检,痰液和肺泡灌洗液则直接放入无菌容器内密封送检。
这些容器内无添加任何成分,或者只含有无菌生理盐水,无保护RNA稳定的作用。新冠病毒是一种RNA病毒,样本保存容器内存在降解RNA的酶,样本中的病原体死亡后,RNA裸露,因此易发生RNA降解。
因此取样标本不能放置太久,一般要求采样后5个小时内检测,4℃ 存放不能超过 24 小时。如果存放时间久,要求存放在-70℃冰箱。而且在样本运输过程中,样本必须采取冷链运输,维持在零下20度,一旦冻融次数过多,RNA就会受到损伤,影响检出率。

样本预处理
为了降低生物安全风险,目前的大部分实验室的做法是先对样本进行灭活处理。样本到达实验室后,置于56℃环境中灭活至少30min,静置10 min至室温(避免气溶胶),然后进行核酸提取。

这样的处理方式能有效灭活病毒,但病毒的RNA在生理盐水中会很快降解,从而导致后续检测结果为阴性。且RNA在生理盐水中时间越长,降解越多。对于病毒含量较高的样本,未降解的RNA还能被检测到。但病毒含量较低的样本,就很可能因此出现假阴性的情况。

核酸提取
能否提取出高质量的核酸则是核酸分子生物学试验中的关键,提取方法的灵敏度、 特异性也将直接关系到后续试验的成败。因此核酸提取是核酸分析中最关键的方法。目前核酸提取方法主要包括经典的酚氯仿抽提法,新发展的硅胶膜吸附法、磁珠分离法等。传统的酚氯仿抽提法一般适用于实验室简单抽提,对样本总体要求较低,不适用于快速诊断试剂配套使用。目前核酸检测过程中,高效、便捷、环保、大通量、自动化成为核酸提取技术发展的主流方向。现阶段使用较多的主要为滤膜吸附洗脱和磁珠分离法。
磁珠提取法较滤膜法相比,减少了因滤膜中吸附的RNA无法彻底洗脱造成的影响,提取产物纯度高、得率高。贵州省疾控中心传染病防治研究所对提取咽拭子样本中手足口病毒过程中的滤膜法及磁珠法进行了比较。结果显示磁珠法检测病原的重复性较高(CV磁珠法<CV滤膜法),滤膜法次之;磁珠法提取的病毒核酸检测的灵敏度较高(ΔΔCt磁珠法<ΔΔCt滤膜法):

新型冠状病毒同为RNA病毒,且目前采样方式主要为咽拭子采集,根据实际检测效果比较,新型冠状病毒更适合用磁珠法进行核酸提取。

扩增检测
目前新型冠状病毒检测主要方法为实时荧光RT-PCR法。RT-PCR是将RNA的反转录(RT)和cDNA的聚合酶链式扩增(PCR)相结合的技术。一般的RT-PCR分为一步法RT-PCR和两步法RT-PCR。一步法RT-PCR在处理大量样品时易于操作,有助于减少残余污染,因为在cDNA合成和扩增之间不需要打开管盖。一步法可以得到更高的灵敏度,这是因为整个cDNA样品都被扩增。相比之下,两步法RT-PCR由于反转录和PCR检测过程相互独立,最终检测样本量在实际操作过程中被稀释。而目前的一些新冠核酸检测试剂盒采用两步法,这可能影响检测灵敏度。
提升检测灵敏度,减少假阴性,更好的做法是什么呢?
1. 样本采集环节:尽可能选取病毒含量高的样本类型,并采用灵敏度高的试剂进行检测。
2. 保存运输和处理环节:采集后,直接放入能保护RNA不降解的保存液中,再进行封装和后续的高温预处理。
3. 核酸提取环节:选用得率更高的磁珠提取方法。
4. 扩增检测环节:反转录和扩增应在同一体系中进行,上样量增大,且不会造成样本稀释。
办法
仁度的新冠病毒核酸检测假阴性解决方案
1. 样本保存液:病毒灭活、保存、运输、预处理一步到位
采用专利技术的样本保存液,采集的样本立即放入带有保存液的样本保存管,瞬时灭活病毒,并保存RNA在常温运输和高温预处理中不降解。之后样本管直接上机检测,大幅减少运输处理中的生物安全风险。
2. RNA捕获探针法核酸检测试剂盒:特异性磁珠提取、一步快速扩增
采用专利的特异性靶标捕获法磁珠提取技术,只提取病毒RNA,排除其他核酸或杂质干扰,获得高纯度模板。磁珠中原管加入扩增体系,所有提取的RNA全部参与扩增检测,大幅度提升模板量。
实时荧光恒温扩增检测技术,反转录和扩增同步进行,扩增速度是RT-PCR的500倍,对含量较低的样本,能快速捕捉到扩增信号,提高灵敏度。
3. AutoSAT全自动核酸检测分析系统:每一步操作都是精确的标准动作
配套全自动平台,核酸提取,扩增检测和结果分析集成在一台仪器上完成,无人工操作偏差。AI智能软件分析系统,结果判读标准化,排除人工判读的个体偏差。


上海仁度生物科技有限公司成立于2007年,是国内专注于RNA分子诊断,少数以研发驱动的创新型企业,依托公司专利的SAT-RNA技术平台,建立了完整的全球IP和专利链,目前已有10个病原体分子诊断试剂产品及4个配套仪器产品。其中呼吸道系列包括甲流产品以及肺炎支原体产品等,可辅助鉴别诊断其他病原体造成的肺炎。





 沪公网安备 31011502014243号
沪公网安备 31011502014243号