
新品上市!内标定量全自动HCV RNA高敏检测重磅来袭!
2024年2月4日,仁度生物“丙型肝炎病毒核酸测定试剂盒(RNA捕获探针法)”正式获批上市。
注册证编号:国械注准20243400254

产品性能优越
灵敏度高不漏检:检测下限15 IU/mL,符合指南要求
内标定量更精准:内标全程参与提取、检测并用于定量,消除管间差,定量更精准
全自动检测更稳定:搭载全自动核酸检测分析系统(AutoSAT),采血管原管上机,样本进结果出,核酸提取、扩增、结果分析全自动完成,避免人工操作误差
灵活上机不浪费:打破批次,1-80个样本灵活上机,100分钟出结果

消除丙肝,势在必行
丙肝是由丙型肝炎病毒(HCV)感染引起的病毒性肝炎,主要经血液、母婴及性接触等途径传播。绝大多数丙肝患者在感染前期没有任何临床症状,在不知不觉中进展为终末期肝病,如肝硬化、肝细胞癌等,所以也被称为“沉默的杀手”。
2020年我国HCV感染者948.7万人,年新发感染157.5万人,位于全国甲乙类传染病报告发病第四位。且从2002年至今,丙肝报告总病例数仅300万例,就是说仍有70%的HCV感染者并没有被发现。
2018年2月,全国疾病预防控制工作会议启动实施“中国2030年消除丙型肝炎危害行动”,WHO要求2030年HCV诊断率达90%,治疗率80%,然而2020我国HCV诊断率仅为33%,治疗率11%,距离WHO的制定的2030年消除病毒学肝炎的目标还有很大差距。
为完成2030年工作目标,国家九部委联合发文《关于印发消除丙型肝炎公共卫生危害行动工作方案(2021-2030年)的通知 ,指导和督促丙型肝炎消除行动。要求加大检测力度,提高检测发现率,实施医疗机构“应检尽检”、重点人群“应检尽检”、大众人群“愿检尽检”、抗体阳性者“核酸检测全覆盖”策略。
丙肝消除行动势在必行,需要公共卫生组织、医疗机构、相关检测及药物企业共同努力。
HCV RNA是丙肝诊断及治疗必查指标
由于HCV感染目前无有效预防性疫苗,早诊断早治疗是防治慢性丙型肝炎的关键,HCV RNA是丙型肝炎诊断及治疗中不可或缺的指标,《丙型肝炎防治指南(2022年版)》对于HCV RNA的应用有如下指导。
一
丙肝诊断
对HCV感染高危风险的人群进行抗体筛查。我国HCV感染流行率超过0.1%,建议进行全员成年人的抗体筛查。抗体阳性者全面覆盖进行核酸检测。
自身免疫性疾病患者、血液透析和免疫功能缺陷或合并HIV感染者可出现抗-HCV假阴性,急性感染者处于窗口期出现抗-HCV阴性,可使用HCV RNA确诊。
二
判断治疗起点及终点
HCV RNA阳性患者,均应接受抗病毒治疗。抗病毒治疗终点为治疗结束后12周,采用敏感检测方法(检测下限≤15 IU/mL)检测不到血清或血浆中HCV RNA(SVR12)。
三
治疗前评估
采用敏感检测方法(检测下限≤15 IU/mL)进行血清或血浆HCV RNA定量检测。
四
治疗过程中的监测
患者治疗过程中应进行疗效监测和安全性监测。疗效监测主要是检测HCV RNA,应采用灵敏度高的试剂(检测下限≤15 IU/mL)。建议在治疗的基线、治疗第4周、治疗结束时、治疗结束后第12周检测HCV RNA。
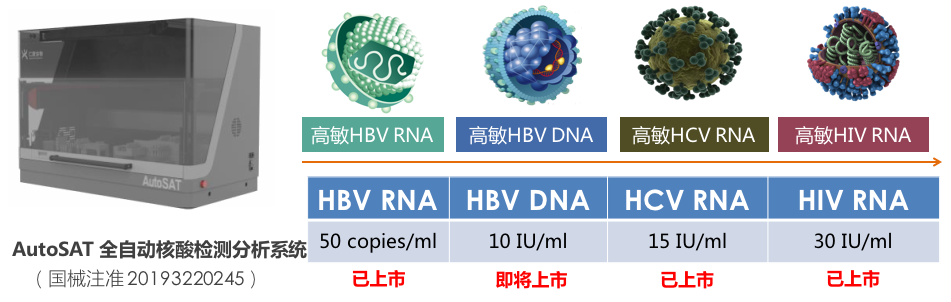
仁度生物血源传染病全自动检测系列
仁度生物始终坚持在RNA领域深耕,本次上市的新品HCV RNA虽然不是创新性标志物,但通过内标定量及全自动流水线平台在传统检测技术基础上进行了更新迭代。全自动检测是定量分子产品的发展趋势,仁度生物的血源传染病系列始终坚持全自动检测的发展路线,目前全自动核酸检测分析系统(AutoSAT)搭载的HBV RNA、HIV
RNA、HCV RNA检测试剂均已上市,HBV DNA产品也即将上市,一台仪器实现乙丙艾三大疾病的全自动检测,值得期待。






 沪公网安备 31011502014243号
沪公网安备 31011502014243号